O FENOMENAL MUNDO VEGETAL
Portifólio online voltado para a disciplina de Histotécnica vegetal ministrado pela professora Márcia, onde ficará registrado todo o aprendizado passado de aula em aula ao longo do semestre.
Autoavaliação: versão final
As aulas práticas de histotécnica vegetal foram de longe, as aulas nas quais a turma mais desenvolveu independência em laboratório, característica essencial para a profissão. Durante longas manhãs aprendemos a preparar reagentes e corantes, assim como efetuar os cálculos das soluções necessárias para os mesmos. Também aprendemos diversas formas de cortes de tecido vegetal, como corte transversal da folha, corte paradérmico, corte longitudinal, técnica da impressão da epiderme e diafanização. Além de processamento de material vegetal em historresina, como aplicar etapas de desidratação, pré-infiltração, infiltração, microtomia, coloração, emblocamento e montagem dos três tipos de lâminas: temporárias, semi-permanentes e permanentes. Não esquecendo de mencionar, a oportunidade de conhecer o Laboratório Central de Microscopia e Microanálise (LabCEMM) da PUCRS, podendo ver de perto um microscópio eletrônico de varredura, como funciona sua rotina de análise e manutenções.
Apesar de as vezes estar desmotivada por conta do cansaço, com o passar das horas em aula, o interesse vencia o desânimo e o sentimento que permanecia era fazer o meu melhor. No início do semestre, ainda me sentia perdida em relação a fisiologia vegetal, mas com a base teórica obtida nas primeiras aulas e observando lâminas que eu mesma produzia, aprendi muito sobre tecidos vegetais e suas organelas em geral, de forma que as observações microscópicas foram ficando naturalmente mais fáceis de se analisar, sem contar o aprimoramento com os cortes vegetais para lâminas histológicas, dos quais de início lembro ter achado que nunca conseguiria aplicar.
Como aluna, não posso deixar de parabenizar a professora Márcia por sua metodologia fenomenal, reconhecendo a grande oportunidade de aprender com essa ótima profissional, pois coordenou a turma dentro do laboratório de forma organizada e controlada, mas ao mesmo tempo dando a liberdade que precisávamos para pensar com autonomia.
Reconheço que sem duvida poderia ter sido mais entusiasmada em sala de aula, mas durante um semestre muitas coisas acontecem e o mesmo é muito exaustivo. Também reconheço que por conta das aulas melhorei muito em como trabalhar em grupo, mas ainda posso melhorar mais. Se eu tivesse que me dar uma nota, hoje, essa nota seria 9. Pois apesar das imperfeições, sei que me esforcei bastante para atender as exigências solicitadas.
E assim encerro este portifólio, agradecendo primeiramente a professora Márcia Bundchen por transmitir de forma tão ponderada seus conhecimentos da área, agradeço também aos colegas e técnicos por ajudarem a realizar as aulas práticas de forma eficiente, mas acima de tudo desejo a todos ÓTIMAS FÉRIAS!!
Processamento de material vegetal em historresina
Os tecidos a serem processados para estudo ao microscópio devem ser preparados de modo a preservar sua estrutura original ao máximo possível. Entretanto, isso não é possível e todos os preparados apresentam artefatos, que são alterações produzidas nas células pelas técnicas utilizadas. Podemos resumir os passos das técnicas histológicas com a seguinte seqüência: fixação dos tecidos, desidratação, inclusão, microtomia (corte em fatias finas), coloração e montagem de lâminas. Essas etapas serão descritas adiante. (ICB-UFMG. 2012)
Materiais
- Amostra vegetal coletada para observação
- Pipetas Pasteur e de vidro
- placas de Petri e béquer
- pinça, pincel e lâmina de aço
- Provetas
- Agitador magnético e placa aquecedora
- Microtubos
- Dessecador e bomba a vácuo
- Lâminas e lamínulas de vidro para microscopia
- Fitas de papel filtro (para secar excesso de água na lâmina)
- Bloco de sustentação da resina e suporte de isopor com baixa granulometria
Reagentes
- Álcoois 70%, 80%, 90%, 95%
- FAA 70%
- Solução de pré-infiltração (álcool 95%)
- Solução de infiltração (10mL de resina líquida + 0,1g de pó ativador)
- Meio de emblocamento (15mL de solução de infiltração + 1mL de hardener)
Inicialmente é preciso dispor todos os materiais previamente selecionados sobre uma bancada. Na maioria dos casos é preciso seccionar, com auxílio de uma lâmina de barbear, o órgão da planta coletada em fatias finíssimas. Pois, em microscópio óptico, a formação da imagem ocorre pela passagem de luz através da amostra. (LAVEG-UFSC. 2014)
ETAPAS
Desidratação
Para a desidratação o material deverá seguir em uma sequência crescente de álcool etílico, em nossa aula usamos em concentrações de 70%, 80%, 90% e 95%, permanecendo 30 minutos em cada etapa, dentro de um dessecador a vácuo. Nesta desidratação a água presente no material é retirada, o que garantirá uma boa infiltração posterior. Dependendo da capacidade de infiltração do material é possível pular algumas etapas na sequência para agilizar o processo. (LAVEG-UFSC. 2014)
Pré-infiltração
Essa etapa consiste em transferir o material do álcool de concentração 90% de um microtúbulo para outro de concentração 95% + a solução de infiltração (0,2mL) e deixar por 30 minutos, para remover completamente o álcool e preparar o tecido para a penetração da resina.
Infiltração
Dentro do dessecador a vácuo, mesmo o ideal sendo uma hora, deixamos em microtúbulos as amostras imersas durante sete dias na solução de infiltração (1,5mL). A infiltração dos elementos teciduais em parafina é importante, pois a parafina também é o meio de inclusão tecidual. Estes meios tornam a amostra resistente para suportar os impactos provenientes do processo de seccionamento.

Microtomia
O micrótomo é um equipamento essencial para montagem de lâminas permanentes pois permite o secionamento da amostras na espessura de alguns micrômetros. (LAVEG-UFSC. 2014)
Seccionamos a amostra em torno de 10 micrômetros, depositando os melhores cortes em água morna para que o material *se esticasse* e com o auxílio de um pincel, depositamos a amostra na lâmina, deixando-a secar em cima de uma placa aquecedora.

Coloração
Existem diversos corantes e reagentes que permitem a visualização das estruturas celulares e o seu reconhecimento, em aula usamos o azul de toluidina e fúcsia para corar nossas amostras.
Em uma cubeta, a amostra foi mergulhada em azul de toluidina por 2 minutos e em seguida lavada com água da torneira. Em outra cubeta, desta vez com o corante fúcsia, a amostra foi deixada por 10 segundos e lavada novamente com água da torneira.
Emblocamento
Feito o preparo do meio de emblocamento (3mL de solução de infiltração + 200uL de Hardener), o mesmo foi colocado imediatamente nas forminhas dispondo o material dentro da forma cuidadosamente. A forma foi mantida em cima de uma placa aquecedora até o inicio da polimerização que ocorre que forma mais rápida no calor e depois transferido pra estufa em 40-50°C até o endurecimento completo.
Após o endurecimento as amostras são desenformadas e coladas em blocos de sustentação de madeira com "super-bonder", a partir disso o material será devidamente corado e serão feito os cortes em micrótomo
Montagem de lâminas
Lâminas temporárias
As lâminas temporárias são de fácil preparo e duram por poucos dias, além de rapidamente desidratar, inviabilizando a observação microscópica Com auxílio de uma pipeta Pauster, coloque uma gota de água sobre a lâmina. Utilizando uma pinça pegue secções da amostra, presentes no vidro de relógio, e coloque sobre a gota de água da lâmina. Após, encoste uma das arestas da lamínula no limite da gota de água da lâmina
Materiais
- Amostra vegetal coletada para observação
- Lâminas de vidro para microscopia
- Lamínulas de vidro para microscopia
- Pipeta Pausteur ou conta-gotas
- Becker ou recipiente de vidro com água limpa
- Reagentes ou corantes dependendo do objetivo da observação
- Pinça de relojoeiro com ponta fina
- Pincel
- Fitas de papel filtro (para secar excesso de água na lâmina)
Resultado
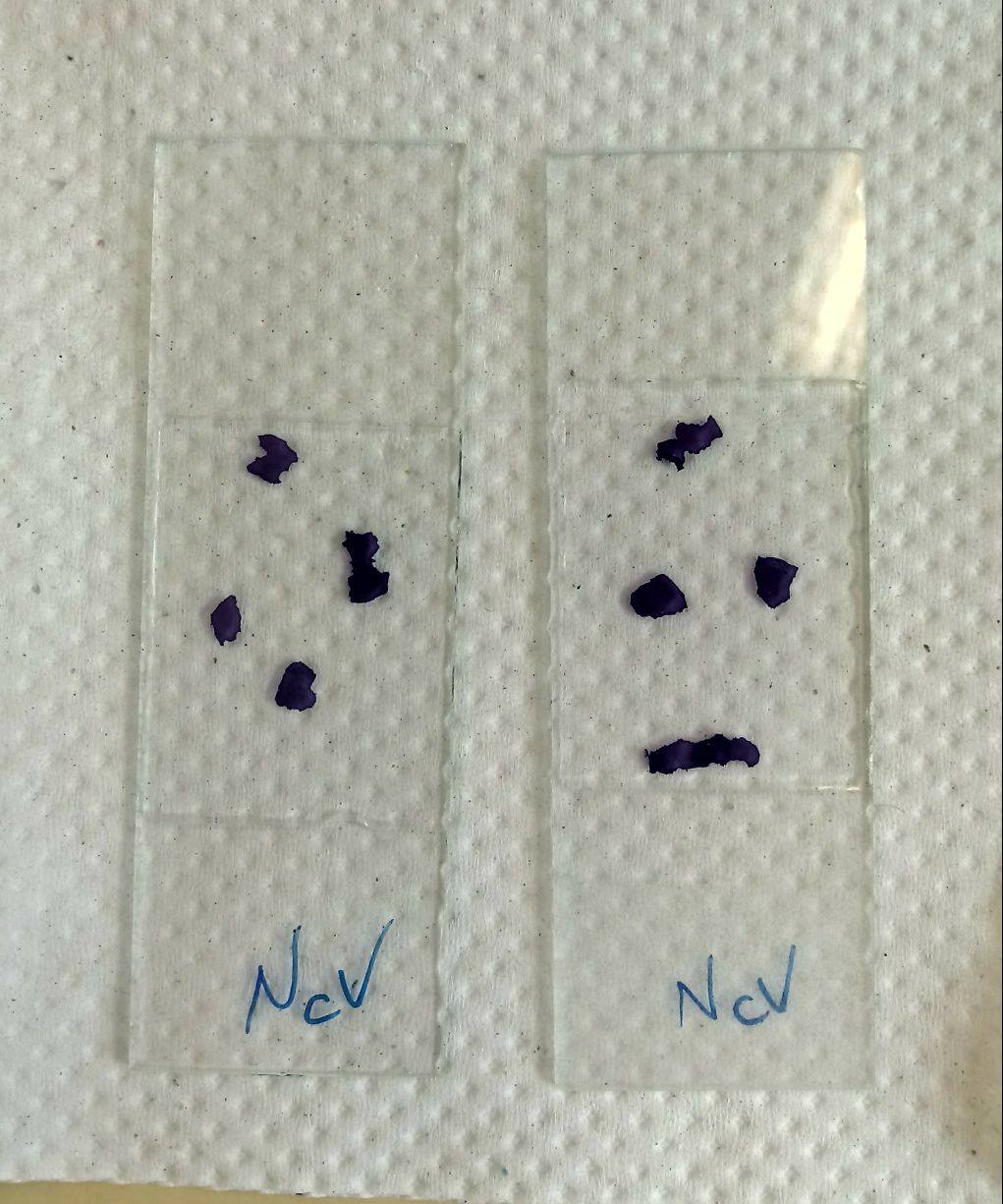
Lâminas Semi-Permanente
As lâminas semipermanentes podem ser guardadas por meses e devem ser preparadas com glicerina. Para fazer uma lâmina semipermanente, primeiramente coloque um pequeno pedaço de glicerinada sobre a lâmina. Coloque uma secção do material in vivo ou fixado sobre a glicerina, cubra com uma lamínula e passe esmalte para unhas de cor transparente nas laterais da lamínula.
Materiais
- Amostra vegetal coletada para observação
- Lâminas de vidro para microscopia
- Lamínulas de vidro para microscopia
- Pipeta Pausteur ou conta-gotas
- Becker ou recipiente de vidro com água limpa
- Reagentes ou corantes dependendo do objetivo da observação
- Pinça de relojoeiro com ponta fina
- Pincel
- Fitas de papel filtro (para secar excesso de água na lâmina)
- Esmalte base para unhas transparente
Resultados

Lâminas Permanentes
Materiais
- Coleta do material
- Fixação (FAA 70°)
- Desidratação
- Infiltração e inclusão (historesina)
- Montagem dos bloco
- Seccionamento em micrótomo
- Coloração da lâmina
- Montagem da lâmina
- Forma molde
Resultados

Técnicas Manuais para Análise de Tecidos Vegetais
"Com instrumentos simples e reagentes de fácil aquisição, é possível obter ótimos resultados para a observação microscópica. Os cortes podem ser obtidos à mão livre, com o auxílio de uma navalha de aço (lâmina de barbear) ou com o material incluído em meios sintéticos e seccionado em micrótomo rotativo." Bundchen, Márcia; Gogosz, Alessandra. 2014
Cortes à mão livre de órgãos relativamente rígidos, como caules jovens que tem suficiente sustentação para não se deformar com o contato da lâmina de barbear, são realizados segurando a amostra diretamente com a mão. Já órgãos mais delgados e tenros, como folhas, necessitam do uso de suportes feitos com isopor. Dispondo a amostra no interior do suorte, obtem-se a sustentação necessária para o deslizamento da lâmina de barbear. (Bundchen, Márcia; Gogosz, Alessandra. 2014)
Técnica do corte transversal livre
Materiais
- Lâmina de aço
- suporte de isopor de baixa granulometria
- Placa de petri
- Pinça
Reagentes
- Água destilada
- Hipoclorito de Sódio
- água acidificada
- corante azul de toluidina
Método
O método de corte transversal a mão livre, em aula aplicado na folha de Ateleia, consiste em fazer um bloco de isopor pequeno, com uma pequena fenta em seu meio com tamanho apenas suficiente para caber a amostra desejada (folha), como podemos ver nas fotos abaixo:

O próximo passo, é passar a lamina de aço bem de leve na parte onde fica posicionada a superfície transversal da folha visando adquirir amostras mais finas possíveis.
Etapas (pós corte)
- 1°: Deixar as amostras em uma placa de petri
- 2°: Transferir as amostras para o Hipoclorito até notar que as mesmas fiquem esbranquiçadas, aproximadamente dois minutos.
- 3°: Lavar a amostra três vezes com água destilada, passando de uma placa de petri para outra esperando 30 segundos mínimos em cada.
- 4°: Passar a amostra para água acidificada, 1 minuto.
- 5°: Transferir novamente para água destilada, aproximadamente 30 segundos.
- 6°: Emergir a amostra no corante Azul de Toluidina e deixar por aproximadamente 1 minuto.
Resultados
Técnica de corte paradérmico
Materiais
- Placa de petri
- Lâmina de aço
- pinça
- Malha extrafina
Reagentes
- Água destilada
- Hipoclorito de Sódio
- água acidificada
- corante azul de toluidina
Método
Antes de iniciar a técnica, podemos transferir amostras de um frasco, imersas em fixador FAA 70% para álcool 70% em outro frasco com o auxílio de uma malha extrafina
O método, em aula aplicado na folha de fuscia régia, consiste em escolher uma amostra (folha), e coloca-la na placa de petri com um pouco de água destilada. Nessa etapa já conseguimos perceber a maior rigidez da folha por conta do fixador. Logo após, cortar a amostra de forma superficial, em um plano paralelo a superfície do órgão. Uma boa forma de ajustar a folha para tal corte, por exemplo, é em volta do dedo indicador segurando-a por baixo do mesmo com os dedos polegar e medio.
Etapas (pós corte)
- 1°: Deixar as amostras em uma placa de petri
- 2°: Transferir as amostras para o Hipoclorito até notar que as mesmas fiquem esbranquiçadas, aproximadamente dois minutos.
- 3°: Lavar a amostra três vezes com água destilada, passando de uma placa de petri para outra esperando 30 segundos mínimos em cada.
- 4°: Passar a amostra para água acidificada, 1 minuto.
- 5°: Transferir novamente para água destilada, aproximadamente 30 segundos.
- 6°: Emergir a amostra no corante Azul de Toluidina e deixar por aproximadamente 1 minuto.
Resultados
Podemos observar a presença da epiderme naqueles alunos que fizeram o corte da parte adaxial (foto 3 da esquerda para direita) da folha, e presença de estômatos e epiderme naqueles alunos que fizeram secionamento da parte abaxial da amostra (foto 4 da esquerda para a direita).
Técnica de impressão da epiderme
Materiais
- Placa de petri
- Lâmina de aço
- pinça
- Esmalte base para unhas
Reagentes
- Água destilada
- Hipoclorito de Sódio
- água acidificada
- Corante azul de toluidina
Método
A técnica de impressão de epiderme, feita na folha da pata de vaca, consiste em passar várias camadas de base transparente para unhas, e após secar, com delicadeza de mãos de fada retirar essa camada esmaltada, colocar em uma lâmina com uma gota de glicerol 50% e levar ao microscópio.
Resultados
Na terceira foto, da esquerda pra direita, podemos visualizar a impressão de epiderme adaxial da planta, onde podemos identificar algumas paredes celulares, condutores de seiva ao fundo da epiderme e pelos. Já na foto número quatro, da esquerda para a direita, com a impressão de epiderme da parte abaxial feita por um colega de classe, foi possível até visualizar os estômatos da planta, fenomenal!
Técnica de corte longitudinal
Materiais:
- Lâmina de aço
- suporte de isopor
- Placa de petri
- Pinça
Reagentes
- Água destilada
- Hipoclorito de Sódio
- água acidificada
- corante azul de toluidina
Método
O método de corte longitudinal, aplicado no caule do chuchu, consiste em cortar com a lâmina de aço de um lado a outro no meio da estrutura do caule em direção vertical, de forma mais fina possível que permita a visualização de tecidos internos.
Etapas (pós corte)
- 1°: Deixar as amostras em uma placa de petri
- 2°: Transferir as amostras para o Hipoclorito até notar que as mesmas fiquem esbranquiçadas, aproximadamente dois minutos.
- 3°: Lavar a amostra três vezes com água destilada, passando de uma placa de petri para outra esperando 30 segundos mínimos em cada.
- 4°: Passar a amostra para água acidificada, 1 minuto.
- 5°: Transferir novamente para água destilada, aproximadamente 30 segundos.
- 6°: Emergir a amostra no corante Azul de Toluidina e deixar por aproximadamente 1 minuto.
Resultados
Nas placas efetuadas a partir do corte longitudinal no caule do chuchu, podemos observar o xilema em forma de mola e mais claro ao lado esquerdo, principalmente das fotos 2 e 3 da esquerda para a direita, podemos observar marcações constantes que representam as placas crivadas, ou seja, ali podemos ver o floema da planta.
Técnica de diafanização
Materiais
- Amostra (timbó)
- Pote de vidro
- Pinça
- Estufa
Reagentes
- ácido acético + peroxido de hidrogênio
- Álcool 70%
Métodos
A técnica de tornar semitransparentes amostras vegetais de tamanhos variados, consiste na dissolução do conteúdo celular, restando apenas a parede celular, o que facilita o estudo da nervação foliar.
ETAPAS
1°: Separar amostra
2°: Preparar a solução diafanizadora
3°: Emergir a amostra na solução e deixar algumas horas, até observar que o material já perdeu o suficiente de sua tonalidade
4°: Após a clarificação, passar a amostra para um frasco com álcool 70% com finalidade de conserva-la até o momento de uso
RESULTADOS
Visita técnica ao LabCEMM
- Microscópios eletrônico de varredura (MEV)
- Microscópio eletrônico de transmissão (MET)
- Microscópio de varredura por sonda ou força atômica (AFM)
Mas o foco da nossa visita técnica era aprender mais sobre o Microscópio eletrônico de varredura por emissão de campo (MEV-FEG)
O Microscópio Eletrônico de Varredura por Emissão de Campo (MEV-FEG), podendo atingir tranquilamente até 500 mil vezes de aumento, é geralmente utilizado para observações de amostras espessas, ou seja, não transparentes a elétrons. Ele fornece imagens com grandes aumentos da superfície de um material, sendo esta imagem similar ao que poderia, hipoteticamente, ser vista pelo olho humano, se ele fosse capaz de enxergar com grandes ampliações. Este aspecto ajuda a simplificar bastante a interpretação de imagens, (Stolf, Daniela. 2015).
Uma fonte de elétrons é focada no vácuo formando
um feixe concentrado, que é varrido sobre a superfície da amostra. As imagens
no MEV são construídas ponto a ponto, de modo similar à formação de uma imagem
de televisão. Quando os elétrons atingem e penetram na superfície, eles
interagem com os átomos da amostra, resultando na emissão de elétrons ou de
fótons. Uma quantidade razoável dos elétrons emitidos é coletada por
detectores, cujos impulsos, com maior ou menor intensidade, são usados para
modular o brilho de um tubo de raios catódicos. Os impulsos de entrada no tubo
variando em x-y são sincronizados com as voltagens de deflexão do feixe
eletrônico, de maneira que cada ponto que o feixe atinge na amostra é mapeado
diretamente em um ponto correspondente da tela, produzindo uma imagem da
superfície da amostra. O aumento do microscópio é simplesmente a relação entre
a área varrida na amostra (ajustável pela variação da voltagem que controla a
deflexão do feixe eletrônico) e o comprimento da linha de varredura sobre o
tubo de raios catódicos, que é fixa. Quanto menor a área varrida na amostra, maior
o aumento observado na tela, (Stolf, Daniela. 2015).
Modo de preparo para as amostras do MEG-FEG
Principais equipamentos para preparo de amostras
- Crio-Ultramicrótomo
- Dimpler
- Ponto Crítico
- Metalizadora
Procedimento de preparo de amostras
- Estabilização da amostra
As amostras são estabilizadas por fixação química, visando torna-las condutoras. Da mesma maneira que a fixação química também responde pela integridade da amostra.
Na formulação do fixador, ajustam-se as condições ideais de concentração, pH, molaridade, etc., de acordo com o material. O fixador é geralmente aplicado à temperatura ambiente, por imersão, (Castro, Luis. 2002).
- Desidratação e secagem das amostras
A amostra devidamente fixada por agentes químicos o que a torna resistente, é desidratado com acetona ou etanol, posteriormente substituídos por gás carbônico liquefeito, na câmara do aparelho de Ponto Crítico. O CO2 líquido é lentamente aquecido, e passa imperceptivelmente da fase líquida para a gasosa; a expansão deste gás dentro da câmara faz a pressão subir, até acima da pressão crítica do CO (73 atm). Mantendo-se a temperatura da câmara acima de 31º C (temperatura crítica do CO2) não há risco de liquefação do gás. Nesta transição de fase gradual, a densidade da fase líquida iguala aquela da fase gasosa. Portanto, a tensão superficial é zero e a amostra é seca sem ultrapassar nenhum limite de fases, isto é, sem o efeito das forças atuantes de tensão superficial. Após a despressurização lenta da câmara até à pressão atmosférica, a amostra é removida seca da câmara, sem alterações sensíveis de forma, (Castro, Luis. 2002).
- Montagem e cobertura
A amostra usada para o MEV-FEG precisa ser montada no suporte porta-amostras do microscópio ("stub"), considerando a melhor orientação em relação ao feixe de varredura e o coletor de elétrons secundários. Conforme as dimensões do espécime, podem ser usados vários tipos de adesivos, representados por colas condutoras de prata ou carbono coloidal; esmalte de unha em quantidade mínima e fitas adesivas também podem ser empregadas. As fitas, por serem isolantes, devem ser recortadas em dimensões reduzidas e bordejadas com um filete de prata coloidal para melhorar a condutividade, (Castro, Luis. 2002).
O trabalho de montagem é feito sob lupa estereoscópica, usando como instrumentos um estilete, palito ou uma pestana aderida a um suporte, (Castro, Luis. 2002).
A camada condutora é geralmente ouro ou carbono, evaporados em vácuo. Basicamente, o metal é arrancado de um eletrodo recoberto com ouro, pelo bombardeio energético de íons positivos. O eletrodo de ouro é ligado ao potencial negativo de uma fonte de tensão da ordem de 1 a 2 KV. Os íons positivos são produzidos pela ionização do argônio, injetado na câmara de descarga, (Castro, Luis. 2002).
A espessura da camada de ouro deve ser suficientemente fina para não influir na resolução da imagem, mas suficientemente espessa, para garantir uma boa produção de elétrons secundários, que serão usados para formar a imagem. Para espécimes mais sensíveis pode-se aplicar uma camada de carbono, evaporado em alto vácuo, antes da cobertura com ouro, (Castro, Luis. 2002).
- Conservação das amostras
Amostras bem preparadas são altamente higroscópicas e devem ser fotografadas imediatamente. Elas podem ser conservadas por certo tempo em um dissecador contendo sílica-gel, se necessário. O maior risco desta conservação diz respeito à instabilidade das fitas adesivas usadas na montagem, pois elas tendem a se retrair, rompendo a condutividade do filme de cobertura, (Castro, Luis. 2002).
Resultados em imagem do preparo de lâminas para microscopia eletrônica de varredura:
Preparo de Reagentes

"Estudos histológicos com plantas podem ser realizados a partir de material recém coletado (fresco) ou armazenado em soluções fixadoras" Bundchen, Márcia; Gogosz, Alessandra.
Um dos fixadores mais usados na histologia vegetal é o FAA e foi com o objetivo de prepará-lo que iniciamos a nossa aula...
PREPARO DE FIXADOR FAA 70%
Vidrarias:
- Proveta de 1L
- Bastão de vidro
- Béquer
- Funil
- Alcoômetro
- Vidro âmbar como frasco armazenador
- Rótulo
Para preparar o fixador, antes teríamos que preparar as soluções faltantes para sua composição, sendo assim, a turma foi dividida em três grupos, cada grupo tinha a responsabilidade de preparar uma solução:
Grupo 1: Preparo de álcool 70%
Em uma proveta de 1L o grupo colocou 700mL de álcool P.A. + 300mL de água destilada, misturaram brevemente com um bastão de vidro e estava pronto o álcool 70%.
Grupo 2: Preparo de álcool 70%
Da mesma forma que o grupo 1, o grupo 2 em uma proveta de 1L colocou 700mL de álcool P.A. + 300mL de água destilada, misturaram brevemente com um bastão de vidro e estava pronto o álcool 70%.
Grupo 3: Preparo de FAA
Composto por formol 5%, ácido acético 5% e álcool 70%, decidimos fazer 1L de solução. Com uma proveta de 1L, dentro de uma capela de fluxo laminar o grupo com o auxílio de provetas de 50mL foi coletado 50mL de ácido acético, 50mL de formol e 900mL de álcool etílico 70% preparado anteriormente pelos grupos 1 e 2. Completando na proveta o volume de 1L, ainda dentro da capela de fluxo laminar transferimos a solução de FAA 70% para um frasco armazenador âmbar e rotulamos.
PREPARO DE CORANTES
"Há diversos corantes disponíveis para uso de forma isolada ou em combinação para o estudo histológico. Alguns corantes são metacromáticos, ou seja, coram determinados componentes e estruturas celulares com uma cor diferente da do próprio corante." Bundchen, Márcia; Gogosz, Alessandra.
Assim como para o preparo do fixador, a turma continuou dividida em três grupos e cada um ficou responsável pelo preparo de um corante específico...
Vidrarias:
- Béquer
- Espátula
- Papel alumínio
- Agitador magnético com peixinho
- Bastão de vidro
- Balança analítica
Corante 1: Azul de Toluidina 0,05% em solução aquosa
Com o objetivo de preparar 500mL de corante, o primeiro passo do grupo foi em uma balança analítica pesar 0,25g de Azul de Toluidina, logo após colocar o sólido em um béquer de 600mL, foi completado o volume até 500mL com água destilada, misturado-o com o auxílio de um bastão de vidro e levado para o agitador magnético sendo homogenizada em torno de minutos. Após finalizar sua homogenização, a mesma foi transferida para um frasco armazenador e rotulada.
Corante 2: Azul de Anilina 0,5% em Etanol 50%
Com o objetivo de preparar 500mL de corante, o primeiro passo do grupo 2 foi preparar o álcool 50%. Sendo assim, em uma proveta de 500mL adicionamos 250mL de etanol P.A. + 250mL de água destilada e misturamos com um bastão de vidro, dando por fim finalizada essa primeira etapa.
O segundo passo do grupo foi em uma balança analítica pesar 2,5g de Azul de Toluidina com o auxílio de papel alumínio, transferir o sólido para um béquer de 1L e completar até 500mL de etanol 50% preparado anteriormente. Em seguida, recebendo uma breve misturada com o bastão de vidro, a solução corante foi levada até o agitador magnético e em torno de minutos estava homogenizada. Após a homogenização da solução, o corante foi transferido para um frasco armazenador e rotulado.
Corante 3: Safranina 1% em solução aquosa
Com o objetivo de preparar 100mL de corante, o primeiro passo que o grupo 3 tomou foi pesar 1g de Safranina em uma balança analítica. Em seguida, em um béquer de 100mL foi colocado o sólido pesado e adicionado até o menisco com água destilada. O grupo misturou a solução brevemente com um bastão de vidro e a levou para o agitador magnético, em torno de minutos depois a solução já estava homogenizada. Após finalizar o procedimento de preparo, o corante foi transferido para um frasco armazenador e rotulado.





